研究グループ紹介
神経科学・分子精神医学グループ
当研究グループは、コホート調査、精神疾患の死後脳検体および遺伝子組換えモデル動物研究を含む基礎研究とオミックス解析、マイクロバイオーム研究研究を、疫学、神経免疫学、分子遺伝学の視点から多角的に捉え、臨床研究と基礎研究の融合させたアプローチを駆使して精神疾患の分子病態解明を目指しています。
研究プロジェクト
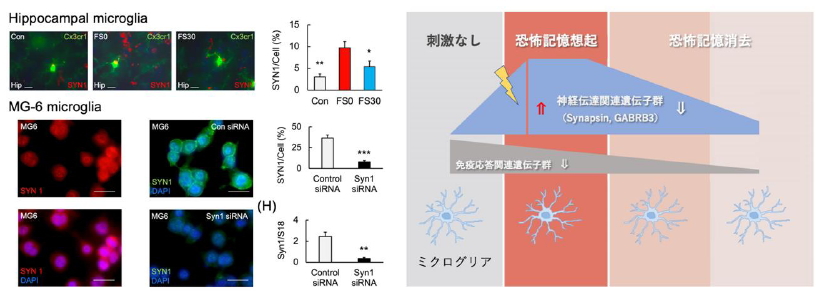
1.恐怖記憶の制御機構におけるミクログリア機能解明
PTSDモデル動物を用いた研究により、ミクログリアが産生する炎症性サイトカインTNF-αが恐怖記憶の維持および消去に関与することを同定しました (Yu et al., 2017)。また、恐怖条件付けに伴いミクログリアのシナプス関連遺伝子発現が変化し、GABA受容体が免疫応答の調節異常に関与することを示しました (Yu et al., 2022; Yu et al., 2023)。さらに、N-アセチルシステイン(NAC)がミクログリアのTNF-α産生を抑制し、特定の条件下ではミクログリア細胞死を誘導することを明らかにしました (Sakai et al., 2023)。本研究では、ミクログリアまたはアストロサイト特異的TNF-α欠損マウスを作製し、行動試験により恐怖記憶の制御メカニズムを検証することで、グリア細胞と神経細胞の相互作用の解明を目指しています。
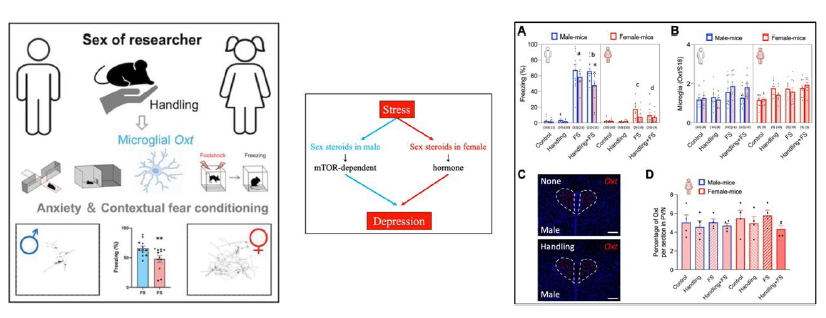
2.精神疾患の性差における分子機構解明と新規治療法の開発
精神疾患の発症リスクや病態には性差が存在することが知られています。例えば、女性のうつ病やPTSDの罹患リスクおよび生涯有病率は男性よりも高い一方で、統合失調症においては男性の方が発症年齢が低く、病態が重篤化しやすいことが報告されています (兪ら, 2024)。しかし、これらの性差が生じる分子機構は十分に解明されておらず、雌の疾患モデルが用いられることが少ないことも要因の一つとして挙げられ、本研究では行動学的・分子生物学的手法を用いて精神疾患の性差を解析することを目的としています。また、統合失調症における前頭前野の性差をRNAシーケンス解析により明らかにし、女性で特異的に変化する遺伝子群を同定しました (Yu et al., 2023)。さらに、実験者の性別がマウスの不安行動や恐怖記憶に与える影響と、その分子基盤としてミクログリアのオキシトシン遺伝子発現の関与についても検討しています (Sakai et al., 2025)。本研究により、精神疾患の性差に関わる分子機構の解明を進め、個別化治療の開発に貢献することを目指しています。
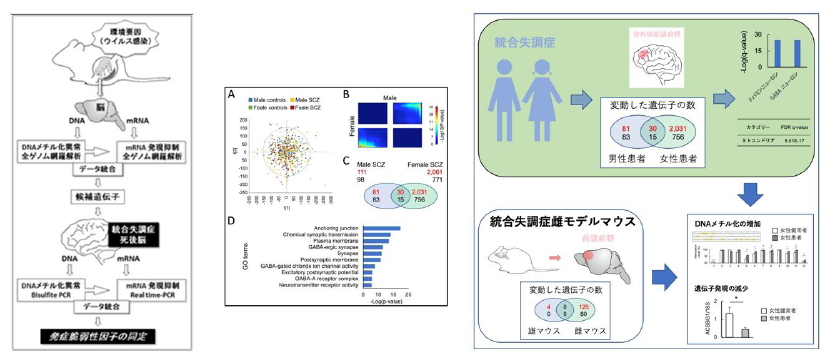
3.胎生期ストレスにおける環境要因のエピゲノム解析と分子病態の解明
胎生期の脳発達は母体のウイルス感染などの環境要因に影響を受け、成長後の統合失調症の発症リスクを高めることが知られています。その発症メカニズムを解明するために、胎生期ストレスが脳のエピゲノムに及ぼす影響を次世代シークエンシング法を用いて遺伝子発現変動に着目して解析し、統合失調症の発症に関わる性差の分子基盤を死後脳検体を用いて検討することにより、女性で特異的に変化する遺伝子群を同定しました (Yu et al., 2023)。さらに、胎生期の免疫活性化(maternal immune activation, MIA)モデルを用いて、DNAメチル化の変化が遺伝子発現に与える影響を解析し、脳の特定領域のトランスクリプトーム解析により、性特異的な遺伝子の発現変動を特定し、分子生物学的視点から臨床症状を裏付けました。さらに、女性で特異的に変化した遺伝子は、抑制性ニューロンに関与していることから、統合失調症の性差におけるリスク因子、および発症メカニズムの解明、その知見に基づいた発症の予測・診断の開発に寄与することが期待されています。
4. 周産期の精神疾患における病態解明とバイオマーカーの探索
周産期における精神疾患の病態解明を目的とし、妊娠期および産後の血漿代謝物、炎症性サイトカイン、精神症状評価尺度、子供の生理的指標や精神疾患に関連する調査データを統合的に解析することで産後うつ病(PPD)の発症に関与する分子機構を明らかにするとともに、GWAS、Multiplex、GC/LC-MS、NMRなどの解析手法を用いて子どもの脳発達に及ぼす影響、妊娠期のバイオマーカーを特定することを目指しています。血漿代謝プロファイルの解析により、PPD女性では妊娠期から産後にかけての代謝変化が健常群と異なり、特にクエン酸回路に関連する代謝異常が確認されました (Yu et al., 2022)。また、抗炎症性サイトカイン(IL-4、IL-10)の低下がPPD発症と関連し、妊娠期の免疫動態の変化がPPDのリスク因子となる可能性が示唆されました (Ono et al., 2023)。さらに産後うつ、ボンディングと幼児の自閉症様症状をコホート調査とモデル動物を用いて、その発症リスクの解明および関連分子メカニズムの検討を行っています。本研究では、妊娠期から産後にかけての生体データを統合し、PPDのバイオマーカー予測モデルの構築とともに、母親のメンタルヘルスが子どもの神経発達において重要な役割を解明し、妊娠期の精神的苦痛が母子双方に及ぼす影響、特に母子の愛着形成への影響を軽減するための早期介入の必要性を明らかにします。
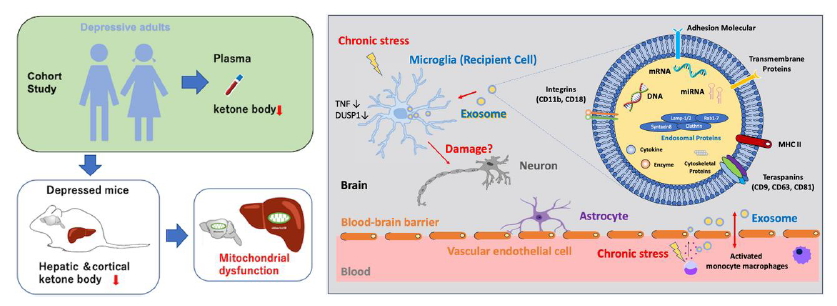
5. グリア細胞の代謝調節と精神疾患の分子機構
本研究では、グリア細胞の代謝調節機構とその破綻が精神疾患の病態形成に及ぼす影響を解明することを目的としています。うつ病患者の血漿代謝解析により、β-ヒドロキシ酪酸(BHB)およびケトン性アミノ酸の低下を確認し、社会敗北ストレス(SDS)モデルにおいて、慢性ストレスが肝臓や脳内ミトコンドリアのBHB生成を低下させることを明らかにしました (Sato et al., 2023)。さらに、ミクログリアのオートファジー不全が炎症を増悪させ、社会回避行動を促進することを示しました(Sakai et al., 2022)。また、CX3CR1遺伝子多型がヒト脳の血流動態に影響を及ぼし、ミクログリアと脳血管系の相互作用が精神疾患の発症リスクに関与する可能性が示唆されました (Sakai et al., 2018)。加えて、ミクログリアにおけるGABA受容体カリウムチャンネルとの関連性を調べています。本研究により、グリア細胞の代謝異常が精神疾患の発症・進行に及ぼす影響を明らかにし、病態の理解を深めるとともに、新たな治療法の開発を目指しています。